最新ニュース
中国 NMPAは2018年度の登録業務に対する報告書を発表
2019年5月31日付、中国NMPAは2018年度の登録申請に関する報告書を発行しました。
主な内容は下記となります。
1. 眼科用超音波診断装置を含む技術審査の為の53のガイドライン発表
2. 外国の臨床試験データ受け入れのガイドライン発表
3. 臨床試験免除リスト改定(現在1254品目が免除リスト)
4. 革新的医療機器登録手順の改定
5. 国産医療機器の登録審査期間の短縮
6. 104の業界標準(YY)、10の国家標準(GB)を修正
2018年末時点 1399の業界標準、219の国家標準があり、国際規格と90%以上整合
7. 医療機器分類カタログを改定
8. 臨床試験に対する管理監督として2回のGCP検査実施
カプセル内視鏡含む20の申請案件に対し現地検査実施
http://www.nmpa.gov.cn/WS04/CL2056/338093.html
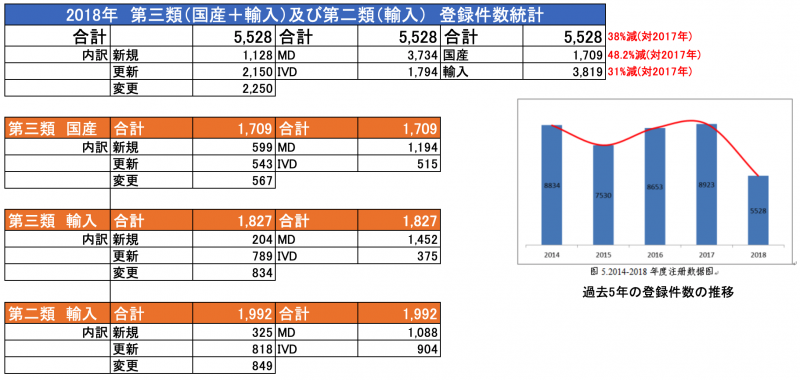
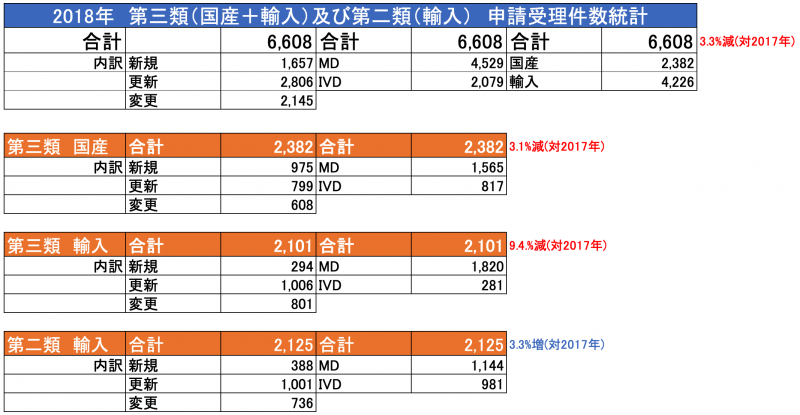
※第二類、第三類の申請・登録件数の統計データは別途ご案内いたします。
テュフズードジャパン様主催 台湾 医療機器関連規制セミナー開催(2019年7月4日)
弊社では来たる7月4日(木)にテュフズードジャパン様主催の台湾・医療機器関連規制セミナーにて台湾の医療機器セミナーを開催する運びとなりました。
弊社台湾TFDAチームの責任者であるTravis Hsuが下記についてお話させていただきます。
セミナー内容:
■Part 1. 台湾の医療機器規制解説 (基礎)
・TFDA について ・医療機器登録申請者に対する要求事項
・QSD 要求事項
・医療機器登録方法
■Part 2. 台湾の最新情報 (上記参照)
■質疑応答
セミナー内容・お申し込みはこちら
フィリピン 一般医療機器の登録に関する新規制強制化の延期について
昨年フィリピンFDA(PFDA)が発表したAO-2018-002に基づく一般医療機器の新登録規制は、当初本年3月となっていました。
現在、3月から延期となっており、PFDAとの面談の中では2019年度中に確実に実施することは口頭で確認できておりますが、開始月については未定となっています。
※直近の情報では2019年中旬頃と聞いておりますが、PFDAの正式な発表を待つ必要がございます。
弊社でも最新ニュースやニュースレター等で情報を発信して参ります。
クアルテック ニュースレター4月号配信
弊社では毎月アジア・アセアンの最新規制情報を発信しています。
配信をご希望の方はこちらからメールアドレスをご登録ください。
<イメージ>
中国 NMPA申請向け外国での立会い試験開始
中国NMPA申請に向けた試験では、外国メーカーの登録申請においては中国国内の指定された試験所での試験実施が求められます。
この度弊社では外国での立会い試験として、永久据え置き型・腫瘍の治療装置に対する立会い試験をアレンジいたしました。
約2週間の期間で安全、EMC、性能試験を実施いたします。
今週より中国試験所の試験官、弊社北京オフィスのスタッフが製造メーカー様の工場を訪問し試験をスタートしています。
特定の条件を満たす製品・装置のみ、外国での試験が認められ、その試験レポートを使ってNMPAへ申請が可能です。
弊社では既に欧州のメーカー様でも立会い試験の実績がございます。
大型の装置は測定項目が多かったり、操作が煩雑であったり、試験準備に時間がかかったりと試験期間が長期化する傾向があります。
審査途中で再試験が求められると更に時間がかかります。
この点でも、立会い試験のメリットも大きいものがございますので、立会い試験が出来るのか確認したい、又は将来検討されたい企業様はお気軽にお問い合わせくださいませ。
台湾 TFDA医療機器の申請関連費用改定を延期へ
昨年9月にご案内いたしましたTFDAへ支払う申請関連費用の見直し(費用アップ)について、延期するとTFDAから連絡がありました。
時期は未定ですが、見直しは継続して検討を進めています。
香港 規制強制化について
既に香港MDCOよりリリースされていますが、年末から年明けにかけて規制強制化の流れが一段と加速しています。
弊社のこれまでの経験では製品登録申請後に審査員から1回目の照会事項が出るまで4〜6ヶ月**程時間がかかっています。
**製品のリスクによって前後します。
現状、申請から登録まで約1年をプロジェクト納期として進めていますが、強制日決定後は申請が一気に増える為、早めの準備が必要です。
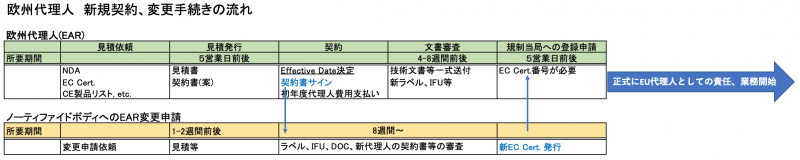
EU 欧州代理人 新規・変更契約の流れと注意点
欧州代理人契約・変更時の注意点:
1. 欧州代理人引受けの審査(テクニカルファイル等)後でないと正式に欧州代理人としての活動は開始出来ない。
代理人による審査には最低4週間前後の時間が必要。
引受をお断りすることがある。
2. ノーティファイドボディによる審査、認証書発行に数ヶ月時間がかかる可能性がある。
3. 代理人変更の場合、既存の代理人との契約書失効日から起算し半年から3ヶ月前には手続きを開始する。
CE対象製品が多い場合、新代理人による審査に時間がかかる為、更に準備期間を長く見積もる必要がある。