最新ニュース
中国 NMPAへのボーダーライン機器の医療機器該非判定、クラス分類依頼
中国NMPAに対する医療機器の該非判定について、類似品(競合他社含む)情報があれば当局のデータベースからある程度判断する事が可能です。
ただ、中国国内でも類似品がない製品については、弊社でもNMPAへ正式に該非判定の申請が可能です。
申請書は弊社にて作成いたしますが、下記の資料のご提出をお願いしています。
まずは今お持ちの書類で申請が可能かお問い合わせください。
1. 中文取説
2. 製品の写真(カタログや取説で確認出来ればOK)
3. 製品に適用された安全規格一覧
4. 日本の認証・承認書、EC Cert. やアメリカ510(k)の登録情報
医療機器に該当する場合、競合他社の登録製品情報も合わせてご案内が可能です。
フィリピン PFDAによる新規制を見据えた対応
フィリピンPFDAによると、審査段階にある80,000件程度の申請について、4,000件程度の申請案件の処理(登録、又は却下)が完了したと報告しています。
PFDA当局は、今後“迷惑な申請”が慢性化されないよう規制・要求事項を更に強化します。
その強化策の一つとして、一定期間中に必要な資料・情報を提出出来ない製造業者の申請を自動的に却下します。
PFDAはこの強化策によってより短期間での審査・登録が可能になることを目指しています。
(インドネシアのように、完成度の高い申請書作成が短期間での登録実現に必要不可欠となります)
詳細は弊社のニュースレターでもご案内いたします。
ニュースレターをご希望の方はこちらからお申し込みください。
プログラム決定 OMETA/Qualtech 海外医療機器規制セミナー2018
EU 迫るMDR/IVDR 対応、現況について
<欧州ノーティファイドボディ(NB)の状況>
-約30(全体の半数程度)のNBがMDR/IVDRに対し申請
-年内にMDR/IVDRの資格を得るNBが出る可能性(?)
<イギリスのNB>
BSI 2018年11月中にオランダで新たにNBとして資格
SGS 既にフィンランドとベルギーにオフィス
UL、LRQA 加盟国の規制当局へアプローチ中
<移行期間>
ある一定条件を満たすことで免除される仕組み
-認証証の有効期限の延長措置
-特定の機器に対する厳しい臨床試験の要求免除措置
<注意>
※上記の情報は不確定な情報を含みます。
※規制やNBの状況は日々変わりますので、常に最新の規制、ガイダンス、NBの情報を参照してください。
※上記の情報によって生じたいかなる損害、問題についてはクアルテック・ジャパン及びクアルテック・グループは一切の責任を負いかねます。
マレーシア MDA 展示会、デモンストレーション用の医療機器登録
先週はマレーシアにてAHWPの年次総会2018が開催されました。
(内容については来たる12月21日(金)に大阪府立男女共同参画・青少年センター(ドーンセンター)にてOMETA様主催セミナーにてご報告がございます)
このタイミングで商談も兼ねてマレーシアへ行かれた企業様も多かったのではないでしょうか。
また、来月にはドイツにてMEDICAが開催されます。
https://www.medica-tradefair.com/
マレーシアにおいて、主に展示会等の臨床用途ではない製品の持ち込み方法について質問がございましたので、下記までご連絡いたします。
主に下記の5つの目的で製品を持ち込む場合には製品登録が免除されています。
EXEMPTION FROM REGISTRATION OF MEDICAL DEVICES
1. The purpose of demonstration for marketing マーケティング活動向けのデモンストレーション
2. The purpose of education 教育目的
3. The purpose of clinical research or performance evaluation of medical device 臨床研究、性能評価
4. A Custom-Made Medical Device; or カスタムの医療機器
5. A Special Access Medical Device 特別な目的をもつ医療機器
免除申請書の内容を確認する事により、具体的な内容を確認することが出来ます。
1.の申請書では、「Trade show, fair or exhibition」と記載されていますので、マーケティン活動向けのデモンストレーションは展示会も含みます。
台湾 TFDA非薬用歯磨き粉、マウスウォッシュが化粧品法の範囲に追加されます
台湾TFDAは非薬用歯磨き粉、マウスウォッシュを化粧品法の中で規制する予定と発表しました。
医療機器同様に申請関連費用も高くなる予定です。
弊社は医療機器登録を専門としておりますが、台湾の化粧品登録も行なっております。
登録に必要な試験代行も可能です。
原文:
マレーシア 医療機器・登録施設 検索用サイトを新設
マレーシアMDAは9月末に2つの検索用ページを公開しました。
自社製品や競合製品、登録法人検索に大変便利です。
1)Registered Medical Device Search
製品、登録番号、代理人、有効期間などの情報検索が可能です。
2)Licensed Establishment Search
下記は弊社の登録情報となります。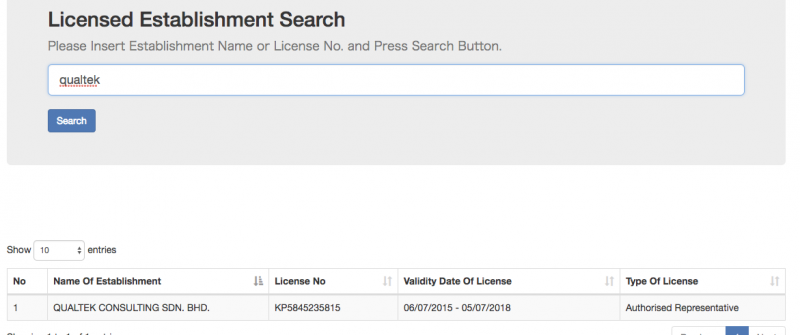
12月21日(金) OMETA/Qualtech 海外医療機器規制セミナー2018のご案内
来たる12月21日(金)、大阪にてOMETA様主催セミナー開催が決定いたしました。
セミナー概要は下記となります。
別途、OMETA様よりセミナーの正式なご案内がございます。
4)につきましては、弊社でもご質問の多い(今更聞けない)内容となりますので、是非この機会にご参加ください。
2)の弊社セミナーについて、聞きたい内容などがございましたら、下記よりご連絡ください。
セミナーの中で出来る限り解説できるように準備いたします。
このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。
++++++++++++++++++++++++++++++++++++++++++++++
1) AHWP年次総会参加報告
2) ASEAN規制のアップデート (弊社にて)
3) ISO13485:2016と改正QMS省令
4) 厚生労働省 医療機器証明書の発給申請のポイント
+++++++++++++++++++++++++++++++++++++++++++++++
マレーシア MDA 2016年6月30日以前に申請した医療機器に対する通知
MDAは2016年6月30日以前に医療機器の登録申請を行い、2018年10月5日までに登録が完了しない申請案件については、登録システムから削除(Drop)されるという通知を出しました。
※削除された機器の申請は再度MEDCASTを通して新規申請する事は可能です。
台湾 TFDAによる医療機器の申請関連費用改定について
台湾のTFDAは2019年7月1日より医療機器の新規登録申請や変更申請に関する新料金表を発表しました。
詳細は下記の原文をご確認ください。
衛授食字第1071605900號附件草案總說明及逐條說明.pdf
運営コストの増加に伴う見直しとなっています。
弊社にてサポートさせていただいている他のアセアン諸国も申請費用の見直しが進んでいます。