最新ニュース
中国 CFDA登録向け国内型式試験サービスを開始
昨日のメールマガジンにてご案内いたしました通り、中国CFDA登録で求められる現地型式試験の国内対応サービスを開始いたしました。
型式試験では安全、EMC、性能試験が求められますが、この度ヨーロッパの企業様で立会試験対応が無事完了し、日本の企業様へも正式にご案内させていただくことになりました。
但し日本国内での試験対応が可能な機器は輸送が困難な大型装置、移動が困難な機器、永久据え置き型機器、特殊な測定器が必要な機器等に限定されます。
※貴社の装置が対応可能かどうかについては、お気軽に弊社までお問い合わせください
国内型式試験サービスでは、中国試験センターの試験担当官を日本に招き、中国CFDA登録向けの立会試験を実施いたします。
来日いただくまで約4~6ヶ月の期間が必要となり、EMC試験からスタートし性能試験、安全試験へと進めます。
ヨーロッパのメーカー様では2週間で全ての試験を完了させました。
試験対応で中国展開を諦めておられた企業様は是非お気軽にお問い合わせください。
無料メールマガジンのご登録はこちらから
インドネシア "MOH製品登録までの流れ" を更新しました
標準審査期間も大幅に短縮されました。
インドネシア市場へのマーケットアクセスはクアルテックにお任せください。
インドネシア 製品登録審査 MOHからの照会事項に対する回答は一回のみへ変更
インドネシアの製品登録ではこれまで当局の照会事項に対し2回の回答の機会がございました。
先週金曜のMOHのセミナーでは、今後当局の照会事項に対する回答は原則1回のみ、10日以内となりより厳しくなっています。
※クラスDの製品は15日以内
各国の製品登録申請では、申請準備がスムーズな登録への成功へとつながります。
弊社のサービス価値は申請資料の品質です。製品登録の遅れ、販売機会のロス等々を最小限にするためにも、是非弊社の製品登録サービスをご検討ください。
マレーシア 医療機器庁 Medical Device Authorityは医療機器の登録期限の延期を発表
マレーシアMDAは当初2017年12月31日を期限とした法令737号を2017年7月25日に発行していました。
今回の延期発表により、現在も登録がペンディング中の医療機器については、"Letter of Acknowledgment Receipt of Application for Medical Device Registration under Medical Device Act 2012(Act 737)" での販売継続が新たな期限として設定された2018年6月30日まで可能となります。
但し、2016年6月30日までに申請を行った事業者の申請に限定されます。
また、MDAはこれ以上の延期は無いとしています。
弊社では本通知の詳細内容をMonthlyLetterにおいてもご案内いたします。
ご登録は無料です。また、原文の英訳文書のご提供も可能です。
ベトナム 保健省はクラスB、C、D品の製品登録を2019年1月1日以降強制へ
弊社は年末にベトナムMoH(保健省)へコンタクトし、新規制の強制化が2019年1月以降に延期となることを確認いたしました。
これはクラスB、C、Dに分類される医療機器に対し、旧の規制(Decree No.30)を2018年12月31日まで適用可=現行の輸入ライセンスで輸入可能となります。
クラスB、C、D品の申請受付時期が遅れていましたので、1年の猶予が設定されました。
クラスC、Dは今月から受付開始(オンライン)となります。
クアルテックはベトナムオフィスを開設し製品登録サービスを開始いたしました。
アジア、アセアン市場へのマーケット・アクセスは実績と経験のクアルテックまでお気軽にお問い合わせ下さい。
年末年始の営業について(冬期休暇 2017/12/29-2018/1/3)
弊社の年末年始の営業時間は下記の通りです。
2017年12月28日(木)まで通常営業
2018年1月4日(木)より通常営業
本年はインドネシアオフィスのIPAK正式登録、日本法人の設立、そしてベトナムオフィスの開設と皆様の海外展開をローカルで直接お手伝い出来る準備が加速した年となりました。
日本法人は現地スタッフを日本に迎え、より一層スムーズなコミュニケーションで様々な課題をタイムリーに解決しお客様の海外展開、売上アップに貢献して参ります。
どうぞ良いお年をお迎えくださいませ。
クアルテック・ジャパン・コンサルティング株式会社
代表取締役 張 印本
村山 剛
アジア規制トレーニングコース in 北京のご案内 2018年1月12日(金)
”Asia Regulatory Training Course” は2011年からAsia Regulatory Professional Association (ARPA) と弊社が共同で企画しています。
2018年1月12日(金)北京のSchool of Biological Science and Medical Engineeringにて開催され、今回は中国CMDEセンターから講師をお招きいたします。
プログラム詳細は下記をご確認ください。
Global_Medical_Device_Regulation_UpdatePractice_at_BUAA_Beijing.pdf
OMETA主催 医療機器規制勉強会へのご参加誠に有難うございました。
先日はOMETA様主催セミナーへご参加いただき、誠に有難うございました。
当日のQ&A時間が限られていました。
ご質問はメールにて受け付けておりますので、下記までお気軽にご連絡ください。
このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。
また、弊社のプレゼンテーション資料の電子データが必要な方も上記メールアドレスへご連絡下さいませ。
来年はアジア・アセアンの規制も次のステージへ進んで参ります。
弊社は17年の経験と実績で貴社の海外薬事対応をバックアップし、確実に製品が登録出来るようお手伝いいたします。
お困りごとがございましたら、どうぞお気軽にご連絡下さい。
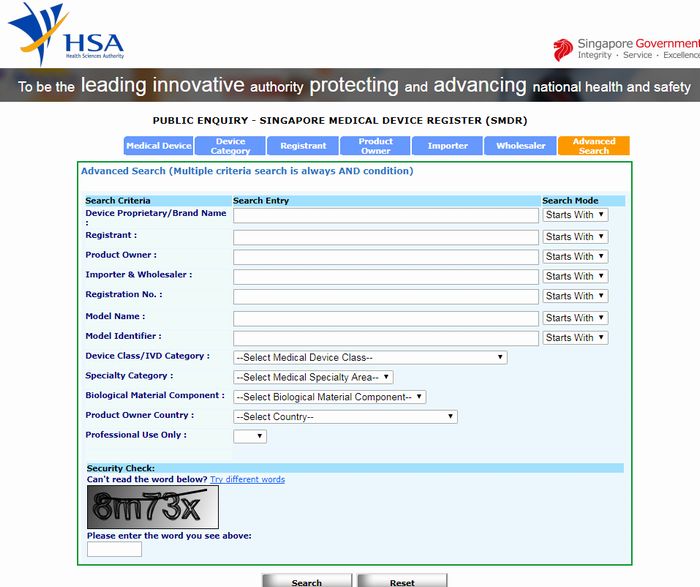
シンガポール 医療機器の登録情報はSMDRのデータベースで検索
シンガポールのHSA(保健科学庁)は医療機器の製品登録はオンライン申請で行いますが、登録情報もオンラインで検索が可能です。
アメリカFDAの510(k)データベースのように、類似品の登録状況、他社の登録製品やその登録者(Registrant)、輸入業者(Importer)等が検索できます。
医療機器としての登録は約18,000件弱、登録者は1,400弱、製品オーナーは約4,900社、輸入業者は約1,200社(キャンセル・失効・保留を含む)が登録されています。
これからシンガポール市場へ進出を目指される企業様との打ち合わせでは、必ずと言っていい程このデータベースへアクセスし、競合他社品の登録情報を検索しています。
製品登録からライセンスホルダーまで、自由度の高いマーケティング戦略の構築にはクアルテックのサービスをご利用ください。
中国 臨床試験の壁。CRO査察も年々厳しく。
中国国内の臨床試験は政府の査察強化もあり、臨床試験の実施を計画される製造メーカー様は実績のあるCROと医療機関をより慎重に選択する必要があります。
弊社は先月のMonthlyNewLetterでもご案内いたしました通り、2016年7月、10月、そして今年10月にGCP査察を受けましたが、無事合格いたしました。
中国のGCP査察は、2016年6月1日のOrder25より正式にスタートし、これまで多くのCRO、臨床評価プロジェクトが不合格となっています。
<QualtechのGCP内容>

弊社では中国・台湾における医療機器専門のCROとして、多くの実績と経験に基づき専門スタッフが最後までサポートいたします。
臨床試験に関するお問い合わせはお気軽にお問い合わせください。